Lutter préventivement contre les maladies du pois de printemps
Il existe un certain nombre de règles à respecter pour anticiper les risques maladies :
A l’échelle de la succession culturale
Respecter les fréquences de retour conseillées
Une fréquence de retour de 6 ans minimum est conseillée pour réduire les risques de maladies, en particulier les maladies racinaires.
Bien choisir ses couverts
Ne pas cultiver de pois ou d’espèces/variétés de légumineuses sensibles à l’aphanomyces dans les couverts ou en tenir compte dans la fréquence de retour du pois en culture de rente.
Eviter les repousses
Les repousses de pois peuvent multiplier certains pathogènes responsables de maladies racinaires, en particulier l’aphanomyces.
A l’échelle de l’itinéraire technique
Choix de la parcelle : vérifier le risque aphanomyces
L’outil Eva permet de classer la parcelle dans un niveau de risque, faible ou élevé. Le test biologique de Potentiel Infectieux (PI) aphanomyces est complémentaire de l’outil Eva. Il permet de connaitre précisément le potentiel infectieux de la parcelle et d’affiner les choix, en particulier si la parcelle est classée en risque élevé.
Privilégier les variétés récentes
Pour limiter le développement de certaines maladies aériennes (ascochytose, botrytis, mildiou), il est important de privilégier les variétés récentes, plus haute et présentant une bonne tenue de tige. Ces variétés permettent en effet d’avoir un couvert plus aéré, créant ainsi un microclimat moins favorable aux maladies.
Par ailleurs, dans le cas de l’aphanomyces, 3 variétés présentent une note de préservation du rendement.
Respecter les densités de semis préconisées
Il est essentiel de ne pas semer trop dense. Un couvert dense maintient l’humidité et favorise ainsi le développement des maladies.
Semer dans de bonnes conditions
Semer dans un sol réchauffé et ressuyé permet de limiter les risques, en particulier pour les maladies racinaires

Réussir son implantation pour limiter la sévérité des maladies sur pois de printemps
Un pois bien implanté sera moins vulnérable aux maladies.

Il est donc indispensable de respecter les dates de semis préconisées, de semer sur un sol bien réssuyé et d’éviter tout facteur de tassement du sol.
Il est également essentiel de ne pas semer trop dense afin de ne pas créer un microclimat favorable au développement des maladies aériennes (ascochytose, mildiou, botrytis).

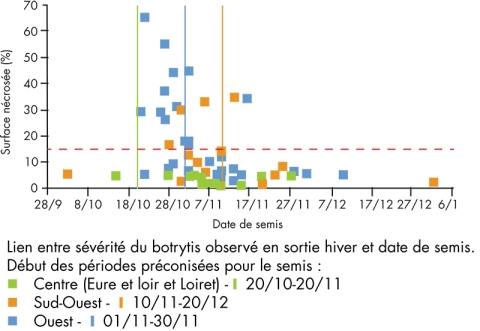
Lutter préventivement contre le botrytis
La nuisibilité du botrytis est évaluée à 15q/ha lorsque la sévérité de la maladie (% de surface nécrosée) atteint 40% en post-floraison. Cette sévérité est systématiquement observée lorsqu’en sortie hiver elle atteint 15%.
Afin de gérer au mieux le risque botrytis voici quelques points clé à respecter.
Le semis doit être réalisé pendant la période préconisée. Un semis précoce entraine un risque de plus de 50% d’observer une sévérité supérieure à 15% en sortie hiver. La dose de semis ne doit pas dépasser le maximum préconisé, une forte densité du couvert étant favorable au développement du botrytis. De plus, il est important d’intégrer les féveroles de culture secondaire (couvert par exemple) dans la conception de rotation et d’éloigner si possible les différentes parcelles de féverole les unes des autres afin de limiter les sources d’inoculum.
Documents à télécharger

Reconnaître le bon stade pour anticiper la protection sclérotinia
Repérer le stade F1 (50 % des plantes avec une fleur ouverte) est la meilleure méthode pour ne pas passer à côté du positionnement optimal de la protection fongicide sclérotinia situé au stade G1 (10 premiers siliques formées de moins de 2 cm) si celle-ci est nécessaire.
6 à 12 jours selon les conditions météo séparent ces deux stades, soit environ 100°C en base 0.
Points de vigilance

Prendre en compte la variabilité de stade
Il est recommandé de déterminer le stade de chacune de vos parcelles. Cette variabilité inter-parcellaire est non seulement liée à des différences variétales mais également à des problématiques ravageurs (altises, charançons) et/ou au contexte pédoclimatique (exposition, asphyxie racinaire, type de sol).
Cette variabilité de stades peut également exister au sein d'une même parcelle. Dans ce cas, c'est le stade majoritairement représenté au sein de la parcelle qui doit être retenu.
Observer le stade de la variété d'intérêt uniquement
Pour lutter contre les méligèthes, le mélange avec une variété haute et précoce à floraison peut être utilisé. Pour déterminer précisement le stade de la variété que l'on souhaite protéger contre le sclérotinia, il faut éviter de comptabiliser ces plantes pièges, de fait plus précoces.
Identifier les stades F1 et G1 : conseil pratique


Sclerotinia : caractérisation de la sensibilité aux fongicides de type SDHI
Recherche par analyse moléculaire (HRM) de mutations sur le gène de la succinate déshydrogénase conférant la résistance aux fongicides SDHI chez Sclerotinia sclerotiorum.
Nous contacter
Adapter l'itinéraire technique du colza pour optimiser l'usage des fongicides
Cette formation s’adresse aux techniciens et agriculteurs qui souhaitent diminuer l'usage des fongicides colza, sans pour autant pénaliser les performances de la culture.
S'inscrire à la formation
Sclerotinia : caractérisation d'une résistance
Recherche d’une résistance de Sclerotinia par la mise en croissance du champignon sur un milieu de culture contenant un fongicide.
Nous contacter

Résistance variétale de la féverole d’hiver à l’ascochytose
L’ascochytose de la féverole (Ascochyta fabae) est une maladie aérienne observée principalement sur féverole d’hiver. Beaucoup moins fréquente que le botrytis, autre maladie aérienne avec laquelle elle est souvent confondue, l’ascochytose peut néanmoins être dommageable et doit être prise en compte dans la gestion globale des risques maladies. Des essais menés en conditions contrôlées et au champ ont permis de montrer que la majorité des variétés présentent des niveaux élevés de résistance à la maladie. Seules deux variétés, Axel et Nebraska, sont plus sensibles.
| Variété | Inscription | Résistance ascochytose |
| IRENA | 2002 - FR | PS |
| BUMBLE | 2014 - GB | PS |
| BERING | 2017 - GB# | PS |
| DIVA | 2002 - FR | PS |
| HONEY | 2011 - GB | PS |
| OLAN | 1992 - FR | PS |
| ORGANDI | 2011 - FR | PS |
| TUNDRA* | 2013 - GB | PS |
| NEBRASKA | 2016 - FR | AS |
| AXEL | 2014 - FR | AS |
TPS : Très Peu Sensible / PS : Peu Sensible / AS : Assez Sensible / S : Sensible
#: inscrit 2019 FR (Brexit)
* n'est plus commercialisé en France
Documents à télécharger

Enquête hernie des crucifères
En quelques clics, vous pouvez nous aider à contribuer à la lutte contre la hernie des crucifères en saisissant les coordonnées de vos parcelles dans lesquelles vous avez identifié cette maladie.
L’enquête permet de réaliser un suivi dynamique de la problématique hernie en France, avec pour objectifs :
- Faciliter le conseil en particulier dans les nouvelles zones
- Identifier de possibles cas de contournements de résistance
- Contribuer à apporter des éléments chiffrés pour alerter et justifier de l’intérêt de la problématique auprès des financeurs
- L’enquête sert aussi d’outil pour nous aider à choisir les parcelles d’intérêt lors d’étude épidémiologiques. Un projet a été déposé récemment pour obtenir des financements dans l’objectif d’établir une nouvelle caractérisation des pathotypes (de hernie) représentatifs du territoire français (réponse attendue cet été).
Un doute sur la maladie ? La hernie des crucifères, maladie racinaire, provoque des renflements ou galles du système racinaire du colza et de nombreuses crucifères dès l’automne. Cela peut conduire à un défaut de croissance jusqu’à la disparition de pieds. A ne pas confondre avec les symptômes du charançon gallicole !
La synthèse des communes est disponible en temps réel sur le site. Toutes les autres informations saisies restent confidentielles. De nombreuses parcelles sont déjà saisies !
L’enquête ne prend que quelques minutes à compléter :

En savoir plus sur la jaunisse de l’aster, une maladie rare et peu nuisible (phyllodie)
Les symptômes de cette maladie appelée jaunisse de l’aster (Aster Yellow - AY), visibles à la floraison du colza sont :
- Des plantes un peu plus hautes que les plantes saines
- Une prolifération des branches
- Une malformation des parties florales ou inflorescences (appelé aussi phyllodie) : les pétales prennent une couleur verte et s’apparentent à des feuilles ; certaines siliques ressemblent à des gousses plates et ne produisent pas de graines ; les siliques « normales » contiennent des graines malformées.
- Une coloration verte persistante tandis que les plantes saines brunissent pendant la maturation.

Exemple de phyllodie sur colza à la floraison
Ces symptômes sont liés à la présence d’un phytoplasme, une bactérie sans paroi et sans forme spécifique. Elle est transmise par des insectes piqueurs-suceurs, principalement des cicadelles, qui s’infectent et transmettent la maladie en passant de plantes en plantes et en se nourrissant de sève élaborée. Le mode de transmission est similaire à celui du virus TuYV par le puceron vert. Ce phytoplasme est présent dans de nombreuses plantes hôtes (espèces cultivées ou non, annuelles, bisannuelles ou vivaces), qui constituent un réservoir potentiellement important. Une transmission possible par les semences est également fortement suspectée.
Peu d’informations sont disponibles en France sur cette maladie. Des cas ponctuels sont observés sur tout le territoire même si les plus nombreux ont été détectés en Poitou-Charentes et dans le Sud-Est. Le nombre de plantes touchées dans les parcelles atteintes est généralement très faible (au maximum 10%) et l’impact sur le rendement très limité. A titre indicatif, une étude canadienne estime des pertes de rendement de l’ordre de 0.3 à 0.7 % de perte par pourcentage de plante touchée.
Aucune lutte spécifique n’est nécessaire.

Réduire le risque phoma par les pratiques culturales
Des pratiques culturales contribuent à réduire fortement le risque de phoma
Broyer et enfouir les pailles des colzas récoltés pour éviter de contaminer les jeunes semis. En zone vulnérable, respecter les durées minimales de maintien des repousses et les dates de destruction prévues dans le cadre de la directive Nitrates.
Le broyage, en réduisant la dimension des résidus, favorise plus rapidement leur destruction, entrainant également celle du champignon.
L’enfouissement des résidus contaminés limitent la production de spores du champignon à l’origine des premières contaminations à l’automne.

Eviter les élongations précoces à l’automne qui sont sensibles aux contaminations.
A cet effet :
- Exporter les pailles du précédent (céréales) ou réduire l'épaisseur du mulch par broyage ou déchaumage.
- Limiter les apports d'engrais organiques en été (objectif : moins de 100 unités d'azote disponibles dans le sol à l'automne) pour éviter des élongations précoces.


Gérer le phoma grâce au choix variétal
Le choix variétal, associé à quelques mesures agronomiques, permet de gérer le risque phoma. Pour cela, les variétés TPS (très peu sensible) sont à privilégier : elles permettent de limiter l’impact de la maladie sur la culture, et de maintenir des pressions faibles en phoma en limitant l’inoculum pour les années suivantes.
La résistance des variétés de colza au phoma repose sur 2 types de mécanismes : la résistance quantitative, et les gènes de résistances spécifiques. Les variétés possédant de la résistance exclusivement quantitative ont un comportement stable. L’efficacité des gènes de résistance spécifique dépend quant à elle des populations de phoma, qui peuvent différer entre régions et dans le temps. L’utilisation de variétés ayant des résistances spécifiques efficaces (RlmS et LepR1) favorise en effet la sélection de souches de phoma contournant ces résistances, engendrant ainsi peu à peu leur perte d’efficacité. Ainsi, les variétés ayant ces résistances doivent être utilisées en alternance avec des variétés ne possédant pas ce ou ces gènes de résistance.
Les types de résistance au phomaLa résistance des variétés de colza vis-à-vis du phoma repose sur deux types de mécanismes : La résistance peut également être apportée par des gènes de résistance spécifique. Les résistances spécifiques agissent au stade précoce de l’infection. Elles sont conférées par des gènes, nommés Rlm ou LepR, qui bloquent spécifiquement le développement des souches de phoma reconnues par ce gène. Ces deux types de résistances ne sont pas exclusifs ! Les variétés peuvent à la fois posséder des résistances quantitatives et des résistances spécifiques ; c’est pourquoi, certaines variétés peuvent rester très peu sensibles au phoma, même lorsqu’elles portent un gène Rlm (ou LepR) contourné, tandis que d’autres variétés voient leur niveau de résistance se dégrader. Ce n’est toutefois que lorsque l’évolution des populations de phoma engendre une perte d’efficacité de ces gènes Rlm (ou LepR) que ce niveau de résistance quantitative se révèle. Les variétés possédant de la résistance exclusivement quantitative ont quant à elles un comportement stable dans le temps. |
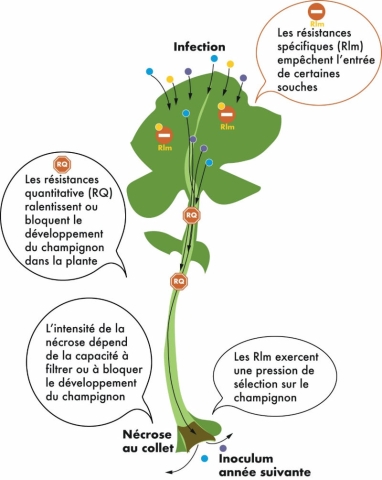
Comment choisir les variétés ?
Pendant longtemps, seul le gène Rlm7 était jugé efficace sur le territoire ; par la suite, c’est le couple Rlm3 / Rlm7 qui montrait une très bonne efficacité. Au fil des années, avec l’utilisation de variétés présentant ces gènes de résistance, le gène Rlm7, couplé ou non à Rlm3, a perdu de son efficacité. Compte tenu de l’évolution des populations de phoma sur le territoire, les résistances spécifiques Rlm3 et Rlm7 ne sont plus considérées comme efficace à ce jour. Parallèlement, des variétés présentant de nouveaux gènes de résistance efficaces voient le jour sur le marché. Dans ce contexte, Terres Inovia vous donne toutes les informations sur les variétés, et ses recommandations pour gérer la durabilité de ces solutions à la parcelle : choisir ses variétés selon son contexte local et son historique
L’utilisation des variétés ayant des résistances spécifiques efficaces doit être raisonnée et pratiquée en alternance avec des variétés ne possédant pas ce ou ces gènes de résistance. Depuis plusieurs années, grâce aux travaux de recherche et de sélection, des variétés sans gène de résistance spécifique efficace montrent de très bons niveaux de résistance quantitative au phoma (classées TPS) : cette alternance des variétés n’accroit donc pas le risque maladie sur la parcelle et contribue à la durabilité de la gestion du phoma.
En termes d’efficacité, les résistances RlmS et LepR1 confèrent à ce jour un très bon niveau de résistance sur tout le territoire.
Pour permettre à chacun d’adapter son choix variétal à la situation de la parcelle, Terres Inovia communique depuis 2019 sur les gènes de résistance présents dans les variétés. L’information sur la présence du gène LepR1 a été ajoutée en 2023 avec les premières variétés déployées en France et possédant ce gène.
|
Variété |
Année et Pays d'inscription |
Représentant |
Phoma |
||
|
Evaluation au champ |
Dernière année d'éval |
Type de résistance |
|||
|
ACROPOLE (2) |
2018 - F |
LG Semences |
S/PS* |
2020 |
Quanti |
|
ADDITION (2) |
2018 - F |
Soufflet Seeds |
PS |
2018 |
Quanti |
|
ALASCO (1) |
2017 - UE |
LG Semences |
PS |
2018 |
Quanti |
|
AMPLITUDE (2) |
2018 - F |
LG Semences |
TPS |
2018 |
Quanti |
|
ANNAPOLIS |
2016 - F |
LG Semences |
PS |
2017 |
Quanti |
|
ARCHIVAR (2) |
2021 - F |
Semences de France |
TPS |
2021 |
Quanti |
|
ASTANA |
2018 - UE |
Saatbau France |
TPS* |
2020 |
Quanti |
|
ATTICA (2) |
2021 - F |
Soufflet Seeds |
PS |
2022 |
Quanti |
|
HERERA |
2021 – F |
KWS Momont |
TPS |
2022 |
RlmS |
Extrait du guide de culture Colza
Toutes ces données sont accessibles dans MyVar, l’outil dédié au choix variétal.
Pourquoi Terres Inovia donne également l’information sur la date de dernière évaluation du phoma ?
Le comportement S/PS/TPS est évalué au champ dans un réseau multilocal sur une à deux années ; toutefois les populations de phoma évoluant, les conditions d’évaluation ne sont pas les mêmes : par exemple, des variétés possédant un gène de résistance spécifique et évaluées TPS dans un contexte où ce gène était encore très efficace et bloquait les infections pourraient avoir un comportement différent aujourd’hui si son efficacité n’est plus optimal : plus l’année d’évaluation est récente (- de 3 ans), plus l’information est fiable aujourd’hui. C’est donc un point d’attention à avoir, pour les variétés ayant des gènes de résistance spécifique efficace. Les variétés dont la résistance repose exclusivement sur de la résistance quantitative ont un comportement stable dans le temps.

La maladie des pois roses
La maladie des pois roses est due à une bactérie, Erwinia rhapontici. Cette bactérie est un parasite de faiblesse qui peut envahir les gousses en fin de saison, en particulier lorsqu’elles sont endommagées.
De petites lésions brunes peuvent apparaitre sur les gousses, les graines contaminées prennent une coloration rose à rouge (ressemblant à celle laissée par certains produits de traitement de semences) et sont parfois ‘ratatinées’. Cette coloration rose est due à un pigment produit par la bactérie.
Cette maladie est assez rare et la proportion de graines colorées à la récolte généralement faible. On la rencontre principalement lorsque la saison est humide, suite des orages ou des averses de grêles pouvant endommager les gousses.

Graines touchées par la maladie des pois roses - en partenariat avec la FNAMS et Océalia
La bactérie peut se conserver dans les graines et les débris de culture. Lorsque les graines sont contaminées, l’émergence et la vigueur des plantes peuvent être affectées. La bactérie pourrait également provoquer une nécrose à la base du collet. Un test réalisé en 2019 à partir d’un lot contaminé et d’un lot sain n’avait pas permis de mettre en évidence un effet de la maladie sur la faculté germinative. Par précaution, il est toutefois recommandé de ne pas semer de lots contaminés.

